引言
2009年,Hans Clevers和其实验室的博士后Toshiro Sato用来源于小鼠肠道的成体干细胞培育出首个微型肠道类器官,掀起了类器官研究的热潮。2011年,Sato等运用类器官技术率先建立了肿瘤类器官,他们是在小鼠结肠隐窝的培养条件的基础上,通过调整培养环境培养人小肠和结肠的类器官,再通过进一步优化调整,从结肠腺瘤和腺癌及Barrett食管中建立肿瘤类器官模型。。癌症患者来源肿瘤类器官模型的建立,被认为是类器官培养技术的又一重大突破,肿瘤类器官是源自肿瘤组织中肿瘤特异性干细胞通过三维组织培养形成的细胞簇,它可模拟体内肿瘤特征及肿瘤细胞异质性,该技术的建立未为癌症研究和治疗提供了可靠的模型,特别是为个性化癌症治疗开辟了新的视野。目前,科研人员通过优化各种培养条件成功产生了许多肿瘤类器官,包括结肠癌、前列腺癌、胃癌、 乳腺癌和胰腺癌、宫内膜/卵巢癌、子宫癌肉瘤、尿路上皮癌和肾癌等。与传统肿瘤研究模型相比,肿瘤类器官可以最大程度地模拟肿瘤在体内的结构和功能,既能直观展现肿瘤生长的过程,又能反映患者个体差异,是一种直观、可靠、高效和避免伦理争议的器官水平研究体系,更加适合于体外的肿瘤生物学和治疗相关的研究。
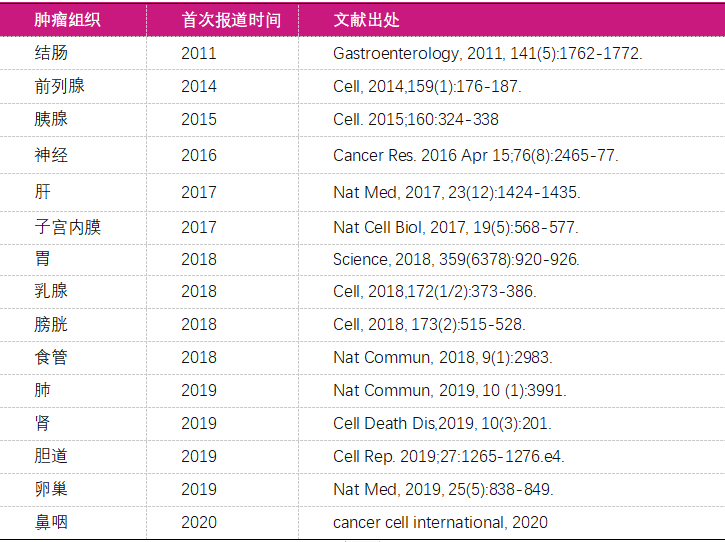
表一:肿瘤类器官发展历程表
一、肿瘤类器官的培养与鉴定
肿瘤类器官将患者肿瘤组织分离获得的肿瘤细胞(含有肿瘤干细胞)在加入一定的细胞因子和小分子建立类似体内的微环境中进行3D培养,形成微型肿瘤模型,其具有与来源肿瘤组织相似的结构特征和功能特性, 而且能够在体外3D培养体系中稳定扩增。肿瘤类器官的涉及到三个关键点,第一是取材,第二是培养方案,第三鉴定方案。
1.肿瘤类器官的取材
肿瘤类器官取材的样本绝大部分都是选择肿瘤组织或者肿瘤细胞,也有少部分是选择用ips细胞诱导。对于取材样本的要求,肿瘤组织的取样方式包括手术,活检,无论什么方式,我们一般要求至少采集三个不同部位,每个部位大概黄豆大小,要避免取到坏死组织,坏死组织颜色上呈现黄色,肿瘤组织样本在取材以及运输过程中可能会引起污染,这就要求我们在取材源头上就要注意可能带来的污染,同时样本应当放在含有双抗(青霉素-链霉素)的组织运送液中,在微生物阳性区域采集的样本除了要加入双抗外,还需要额外添加其他抗生素,例如Primocin(原代细胞抗生素)、vancomycin(万古霉素)、gentamicin(庆大霉素)等。肿瘤组织取到后需要尽快进行处理,将样本剪成乳糜状,加入消化酶进行消化,这个消化方案一般是参考正常组织的消化方法,包括胶原酶,DNA酶,透明质酸等;如果是选用循环肿瘤细胞需要通过对应标记的maker进行分选;如果是腹水里面提取肿瘤细胞需要去除一些杂质细胞,建议收集300-500ml腹水,离心去除杂质,可镜下观察是否有肿瘤细胞。一般穿刺和内镜活检组织培养的成功率较低,因为不可避免会有正常细胞的污染,而在肿瘤类器官培养体系中正常细胞的增值速度是大于肿瘤干细胞。
2.诱导方案的确定
肿瘤类器官诱导培养基的调试是肿瘤类器官培养最关键的部分,肿瘤类器官不同于正常类器官的培养,他的诱导因子不是固定的,因为肿瘤患者本身具有个体化差异,这也导致了商品化的肿瘤类器官培养基开发极其困难。当然这个里面有些成分是固定的,诱导细胞因子也主要是以Noggin, R-Spondin, EGF为主,诱导小分子以Y-27632, N-acetyl-L-Cysteine为主,其他细胞因子和小分子根据对应的正常类器官培养方案进行组合添加筛选。
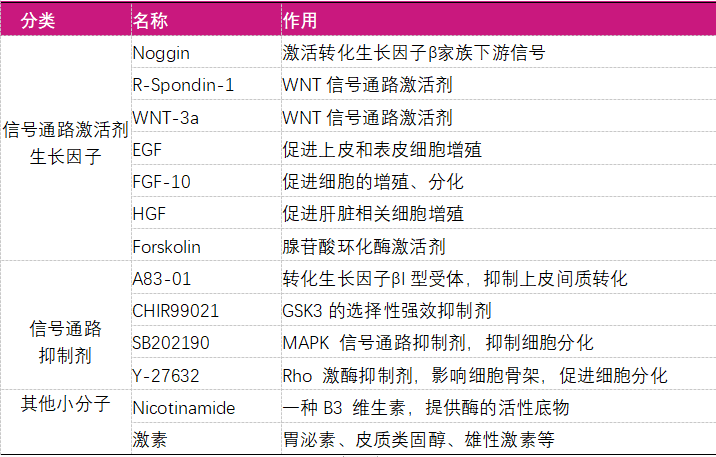
表二:细胞因子和小分子在这个过程中起的作用包括以下这些:
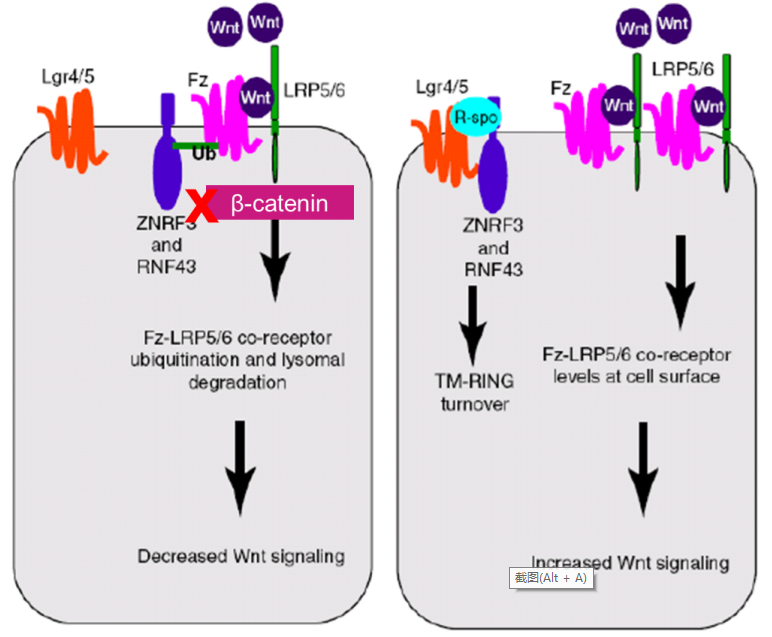
Wnt-R-Spondin-1信号通路激活图(左图单独Wnt,无法激活,右图Wnt+R-Spondin-1可持续激活)
3.肿瘤类器官的鉴定
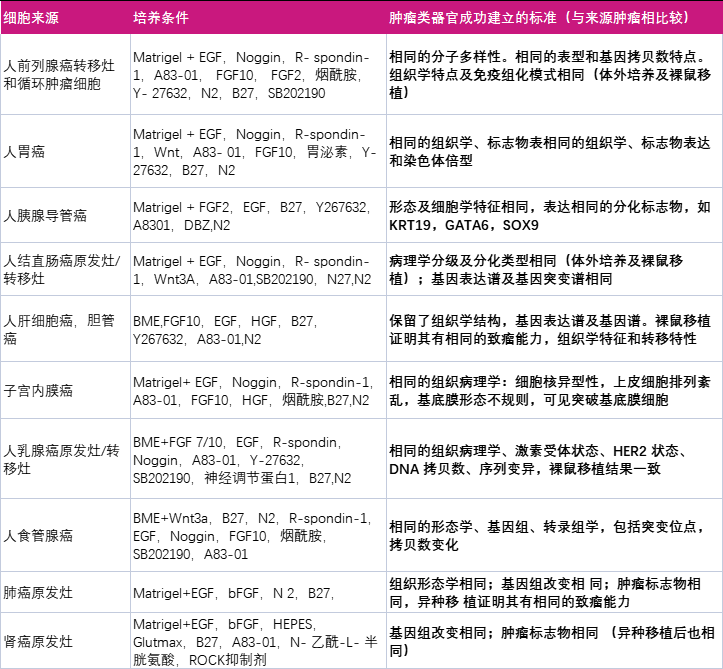
肿瘤类器官的鉴定,从组织病理学进行形态结构观察(细胞水平),肿瘤标志物的染色鉴定(蛋白水平),基因表达变化及基因突变分析(基因水平),药敏活性测试(功能应用)这四个方面与来源肿瘤组织进行比较。培养后的肿瘤类器官需要与来源肿瘤组织保存高度一致。以下表格列出常见种类类器官的培养方案和鉴定标准。
二、肿瘤类器官的优势
肿瘤干细胞被认为是导致肿瘤异质性的重要原因之一,肿瘤干细胞是肿瘤组织中一类具有自我更新、增殖及分化潜能的细胞群,与肿瘤形成、转移和复发密切相关,肿瘤干细胞可分化形成与原发肿瘤中类似的异种细胞,实现了体外模型保留肿瘤异质性的目的。因此肿瘤类器官的应用主要集中在以下四个方面,抗肿瘤药物筛选,药物毒性测定,肿瘤类器官建库,研究肿瘤发生发展机制,我们都知道在肿瘤类器官之前,肿瘤新药的筛选主要依靠体外肿瘤细胞直接培养或者PDX模型,这两种方法缺陷比较明显,首先是2D培养很难模拟体内真实的情况,因此得到的数据参考价值不高,PDX模型虽然可以部分模拟体内的情况,但是其构建成本高,周期长,很多时候肿瘤患者等不急出结果。因此肿瘤类器官模型是目前最优选的肿瘤筛选工具。来自英国伦敦癌症研究所的Nicola Valeri博士就在Science上发表了最新研究通过对71名已经出现转移并且经历了多种治疗方案的晚期结肠癌和胃食道癌患者进行临床实验,发现类器官在预测抗癌药物的有效性上,具有100%敏感性、93%特异性、88%阳性预测值、100%阴性预测值。肿瘤类器官还可以在抗肿瘤药物筛选中辅助进行药物毒性测定,筛选出最优的抗肿瘤药物。
三、肿瘤类器官未来挑战
但肿瘤类器官还具有一定的局限性,其中之一就是该模型中神经、血管及免疫细胞所形成的肿瘤微环境的缺乏,这就使其不能完全表现出肿瘤在体内的发生发展的全部特征,导致细胞或组织失去体内真实的肿瘤形态结构与功能,并丧失异质性。异质性是肿瘤的重要生物学特征之一,与耐药和复发转移密切相关,是肿瘤治疗失败的主要原因,也是肿瘤生物学体外研究结果在临床试验中重复率不高的主要原因之一。未来聚焦到主要可以集中在以下几个方面:
1)提高生成效率,缩短类器官模型的培养周期,降低培养成本;
2)目前的类器官主要来源于上皮细胞,需要进一步研究非上皮类器官的培养方式;
3)目前暂无一个具有类器官的最优培养条件的标准化方案;
4)病理、基因组学、药物敏感度等方面对类器官和肿瘤的一致性进行验证。
类器官作为有着广阔应用前景的技术,有着独特的优势,我们有理由投入更多的时间和精力来发扬它的优势、完善不足、探索新的应用领域,相信会对未来的基础研究和临床诊疗产生积极的影响。
四、肿瘤类器官培养相关小分子和细胞因子
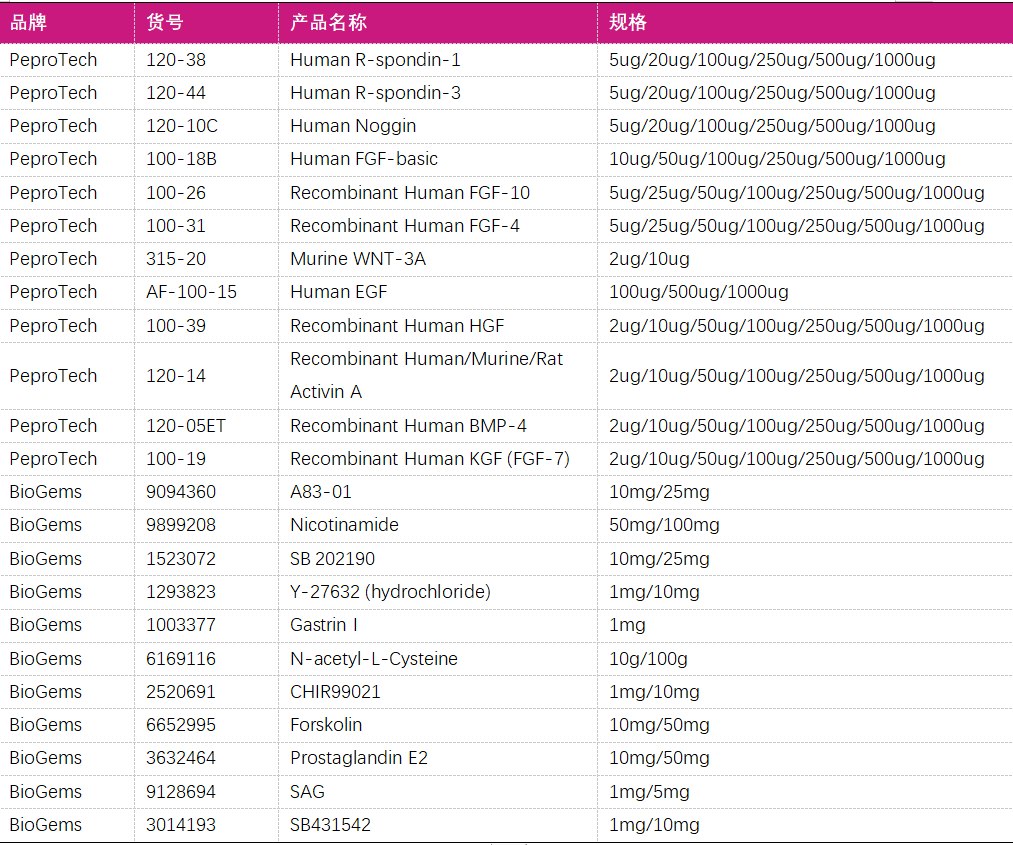
咨询更多产品,请联系我们,BioGems China。
BioGems China
电话:0512-6856 7071
企业QQ:80017 7071
邮箱:china@biogems.com




