一.成人小肠类器官原代培养及扩增体系的构建
2. 用镊子轻刮标本黏膜面去除黏液,将小肠组织标本转移至盛10cm细胞培养皿上,加入一定量的DPBS。
3. 使用灭菌弯尖眼科剪,将组织标本剪碎,直至组织块直径小于1mm,使用预冷1%BSA溶液润洗移液管管壁后,将组织块转移至15mL离心管中。待组织块沉淀后,吸除上清液,加入10mL预冷DPBS, 重悬8-10次。按上述方法漂洗 3-5次,直至上清变澄清。
4. 去除上述澄清液。加入3mL解离缓冲液,使用预冷1%BSA溶液润洗移液管管壁后,将重悬液转移至 6孔细胞培养板中,并加入300μL EDTA(50mM)。冰上震荡消化30min左右,直至大部分隐窝游离。在显微镜下观察,游离的隐窝呈"腊肠样",隐窝原所在位置呈"甜甜圈样。
小肠隐窝消化液:2-5mM的EDTA, 此步骤后可以让组织碎片自然沉降后去除上清,继续消化一次
5. 收集消化后的溶液,让组织碎片通过重力沉降约1min。小心吸出并丢弃消化液,留下足够的液体以没过组织碎片。
6. 将组织碎片重悬于预冷的解离缓冲液,并用移液管上下吹打三次。静置直到大部分肠组织碎片沉降到底部。
7. 小心吸取上清液并使用70μm滤网过滤,将滤液收集于干净的50mL管中。
8. 重复上述6-7步骤几次,直至上清中没有隐窝,将几次获得上清收集在一起。
9. 在2-8℃下将上述收集的上清以200×g离心3分钟。小心地倒出并丢弃上清液。
10. 将沉淀重悬于含有10mL解离缓冲液中。200×g离心3分钟。轻轻倒出上清液。将肠隐窝沉淀留在管中。根据沉淀量加入适当体积的基础培养基重悬沉淀,如果单细胞过多,可再次离心,收集上清以去除单细胞。
11. 计数,吸取10μL置于玻璃载玻片或血细胞计数器上。使用倒置显微镜,计数10μL样本中的隐窝数量,200g离心5min,小心吸出并弃去上清。
12.用类器官培养基将隐窝的密度重悬至8-20个/μL,取出150μL隐窝悬液,加入等体积的未稀释的基质胶混合隐窝,小心地上下吹打十次以充分混匀,注意避免产生气泡。
13. 吸取50μL悬液,加入到提前预热的24孔板每个孔中的中心部位,样品应在每个孔的中心形成圆顶结构。为了防止接种时出现气泡,枪头内液体不要全部打出。
14. 将培养板在37℃下静置10分钟以待基质胶完全凝固。将平板转放入培养箱时,应注意不要破坏凝固后的液滴。
15. 使用移液枪沿着孔侧壁向每个孔中轻轻地加入500μL室温(15-25℃)的配制的类器官扩增培养基。不要将培养基从圆顶结构上直接加入。
16. 向其它未接种的孔中加入无菌PBS以保证培养时的湿度。 将培养板的盖子盖好,并在37℃和5%CO2下进行培养。
17. 隔天进行完全换液。换液时将移液枪头放在孔底边缘小心地将原有液体培养基吸出,并加入为500μL新鲜的室温类器官培养基。
18. 对于原代培养物,7-14天进行传代,对于已经传代的类器官,每7-10天传代一次,以1:3~1:5的比例进行类器官传代,以避免在类器官过度生长和空腔内积累过量的碎屑。
❼ 购买的基质胶在冰上融化后分装冻存,操作过程中基质胶一定要放在冰上,未用完的液体状基质胶可以冻存,若凝固后请弃去。
二.成人小肠类器官的传代培养
三.成人小肠类器官的冻存与复苏
准备冻存液:10%二甲基亚砜(DMSO)+20%胎牛血清(FBS)+70%DMEM/F12。
1. 将需要冻存的类器官冰上放置5~10 min。
从液氮中取出冻存管后,立即放入37℃水浴中,使之迅速融解。等到冻存管中仅存一小片冰室,迅速将细胞转移到含9mL冷的基础培养基中(先将之置于15ml离心管中,放于冰上)。200g 室温离心5min,弃去上清,加入适量类器官培基重悬后与基质胶混合种板,加入含有Y-27632的小肠类器官扩增培养基。
四.成人小肠类器官的分化培养
小肠类器官扩增体系建立后,在传代后的第3~5天将扩増培养基更换为分化培养基,在细胞培养箱中培养。每天在显微镜下观察类器官生长情况,每2天更换分化培养基。分化5-7天后可收集分化的成人小肠类器官进行实验。
五.配制小肠类器官扩增培养基
*扩增培养基可以用于人类肠道类器官的长期培养与扩增,但却不能像小鼠类器官那样可以分化为各种肠上皮细胞!
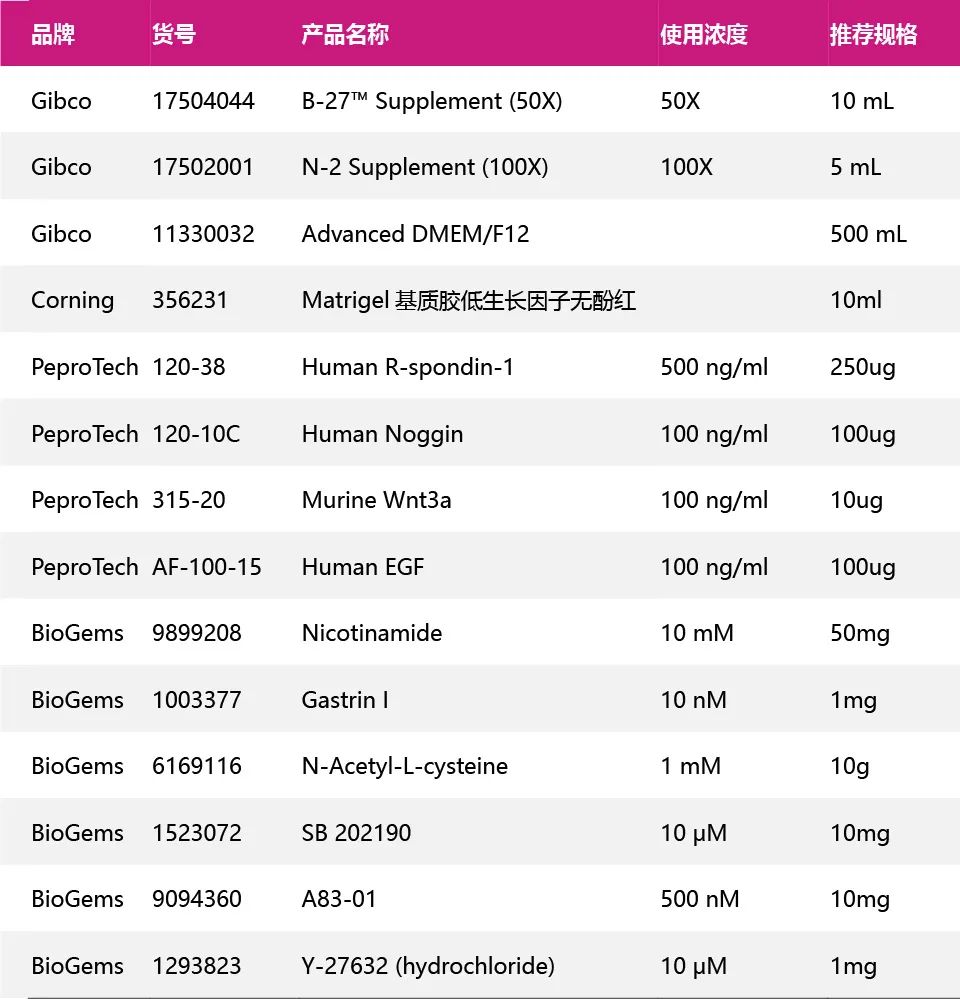
基础培养基:将青-链霉素( 1%) 、10mM HEPES、L-谷氨酰胺(1X)加入至Advanced DMEM/F-12 培养基,第一次种板需要加入Y-27632,后续换液不需要加入Y-27632。
六.配制小肠类器官分化培养基
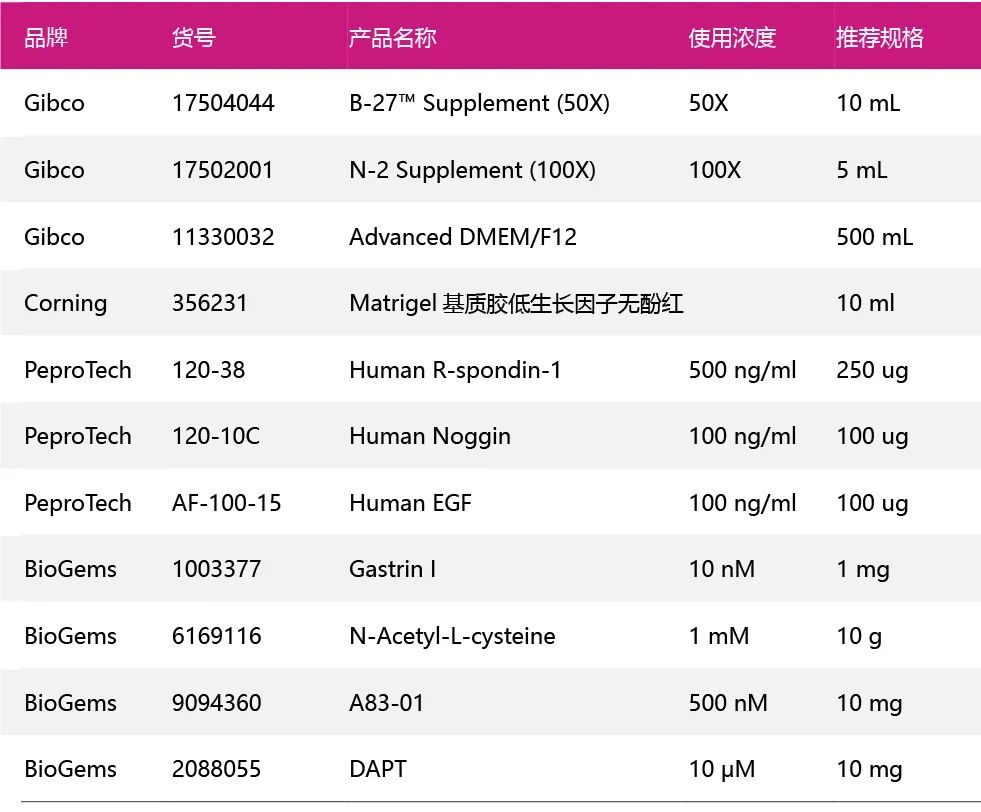
分化培养基在扩增培养基的基础上去除了WNT-3a,SB2020190,Nicotinamide,加入了DAPT。

BioGems China
电话 | 0512-6856 7071
企业QQ | 80017 7071
邮箱 | china@biogems.com
